Лечение локально ограниченного рака молочной железы у женщин на стадиях I-IIA
Локально ограниченные карциномы включают стадии ≤IIA и цель терапии является куративной. Риск рецидива, в первую очередь, зависит от размера опухоли, а также от ее молекулярно-биологических характеристик.
В центре куративной терапии стоит операция (подробнее см. ниже), целью которой является удаление опухоли в пределах здоровых тканей (R0-резекция) с сохранением груди (органосохраняющая операция). Если же органосохраняющая операция невозможна или если сама пациентка ее не желает, то модифицированная радикальная мастэктомия прогностически является равнозначной. Применение таких новых хирургических техник, как мастэктомия с сохранением кожного покрова (Skin-Sparing-Mastektomie) или сосок-сохраняющая мастэктомия (Nipple-Sparing-Mastektomie), позволяют улучшить косметический результат и повышают принятие пациентками своего нового тела.
Мастэктомия
После органосохраняющей операции, как правило, показана радиотерапия для снижения риска рецидива. Облучению подвергается полностью грудь (прооперированная), а также прилегающая стенка грудной клетки (подробнее см. ниже). Конвенциональное облучение и гипофракционная лучевая терапия являются равнозначными методами радиотерапии касательно вероятности рецидива. Дополнительное облучение ложа опухоли (Boost) также снижает вероятность локального рецидива рака молочной железы. Проведение исключительно интраоперационной радиотерапии IORT ложа опухоли не является стандартным методом терапии рака молочной железы у женщин >45 лет, однако пациенткам в возрасте >70 лет и с небольшой опухолью может быть предложена.
Стандартным методом диагностики в Германии метастазов в подмышечных лимфатических узлах при стадии cN0 является удаление дооперационно промаркированных сторожевых лимфатических узлов и их послеоперационного патологического исследования. Данная техника позволяет избежать диссекции всех подмышечных узлов, а также облучения подмышечной зоны при условии, что в удаленных сторожевых лимфатических узлах не выявлены метастазы (подробнее см. ниже).
Адъювантная медикаментозная терапия также уменьшает риск рецидива. При гормонозависимом раке молочной железы рекомендуется на всех стадиях адъювантная гормональная терапия (подробнее см. ниже). Что касается пользы проведения адъювантной химиотерапии, то она зависит от биологических характеристик самой опухоли, стадии заболевания, а также вида и интенсивности терапии (подробнее см. ниже). Более того, при HER2-позитивном раке молочной железы рекомендуется дополнительная терапия медикаментом Trastuzumab.
Хирургическое лечение рака молочной железы на стадиях I, IIA
Грудь
Целью терапии является экстирпация опухоли в пределах здоровых тканей (R0-резекция) и, как правило, операция является органосохраняющей, если выполняются следующие условия:
- инвазивная карцинома с оптимальным соотношением размера опухоли к объёму груди;
- инвазивная карцинома c внутрипротоковыми компонентами, если возможна R0-резекция.
Однако существуют случаи, когда показана исключительно мастэктомия:
- мультифокальная опухоль;
- вероятность неполного удаления опухоли при органосохраняющей операции;
- инфламаторный рак после неоадъювантной химиотерапии;
- предварительно не удовлетворительный косметический результат органосохраняющей операции;
- клинические противопоказания для адъювантной лучевой терапии после органосохраняющей операции;
- пожелания самой пациентки.
Подмышечные лимфатические узлы
Стандартным методом оценки состояния подмышечных лимфатических узлов при cN0 является удаление сторожевых лимфатических узлов (SLNE-Technic), которые еще дооперационно маркируются с помощью специальной субстанции и после их удаления проводится их гистологическое исследование. SLNE эквивалентна тотальной подмышечной диссекции с точки зрения локального контроля на этой стадии, но связана с меньшим количеством побочных эффектов. Диссекция подмышечных лимфатических узлов не показана, если сторожевые лимфатические узлы чистые, т. е. без признаков метастазирования. Также, диссекция не проводится при наличии одного-двух положительных (с метастазами) сторожевых лимфатических узлов, если выполняются следующие критерии:
- ≤ 2 положительных л/у;
- стадия заболевания Т1 или Т2;
- без клинических признаков поражения подмышечных лимфатических узлов (т.е. cN0);
- запланированы органосохраняющая операция и последующая лучевая терапия;
- запланирована адъювантная медикаментозная терапия.
Радиотерапия рака молочной железы на стадиях I, IIA
Грудь и грудная стенка
После органосохраняющей операции показано проведение радиотерапии, целевой областью которой является вся оставшаяся после операции грудь, а также прилегающая грудная стенка. Как показали последние клинические исследования, такая адъювантная радиотерапия позволяет снизить риск локального рецидива у пациенток со статусом N0 с 31% до 19,6%, у пациенток со статусом N+ - на 21,2%. Существует два метода адъювантной радиотерапии после органосохраняющей операции:
- Конвенциональная — 50 Гр (25 сеансов в течении 5 недель).
- Гипофракционная — 40-42,5 Гр (15–16 сеансов в течении 3 недель).
Какой метод показан определенной пациентке с раком молочной железы определяют врачи-радиоонкологи. Облучение грудной стенки после мастэктомии на стадиях I и IIA, как правило, требуется в редких случаях.
Ложе опухоли (Boost)
Дополнительное Boost-облучение ложа опухоли 10–16 Гр значительно уменьшает вероятность возникновения локального рецидива.
Момент проведения адъювантной лучевой терапии
Пациенткам без показаний к проведению адъювантной химиотерапии рекомендовано начать радиотерапию через 4–6 недель после операции. При комбинированной радиохимиотерапии лучевая терапия проводится после химиотерапии, но не позже, чем через 7 месяцев после операции.
Частичное облучение груди (интраоперационная радиотерапия IORT).
Интраоперационная радиотерапия (IORT)
Альтернативой адъювантного облучения является интраоперационная радиотерапия, при которой еще во время операции облучается ложе опухоли с помощью специального аппликатора в течении 20–45 минут дозой 20 Гр. Преимуществом IORT является уменьшение лучевой нагрузки и сокращение срока локальной терапии.
Адъювантная медикаментозная терапия на стадиях I, IIA
HR-позитивный рак молочной железы (адъювантная эндокринная терапия)
Критерием для определения гормонозависимости рака молочной железы является гистологически подтвержденный показатель ≥1% ER- или PR-положительных опухолевых клеток (ER — рецептор эстрогена, PR — рецептор прогестерона). 75–80% пациенток с диагнозом «карцинома молочной железы» относятся к данной группе. В схеме ниже представлен алгоритм терапии гормонозависимого рака молочной железы:
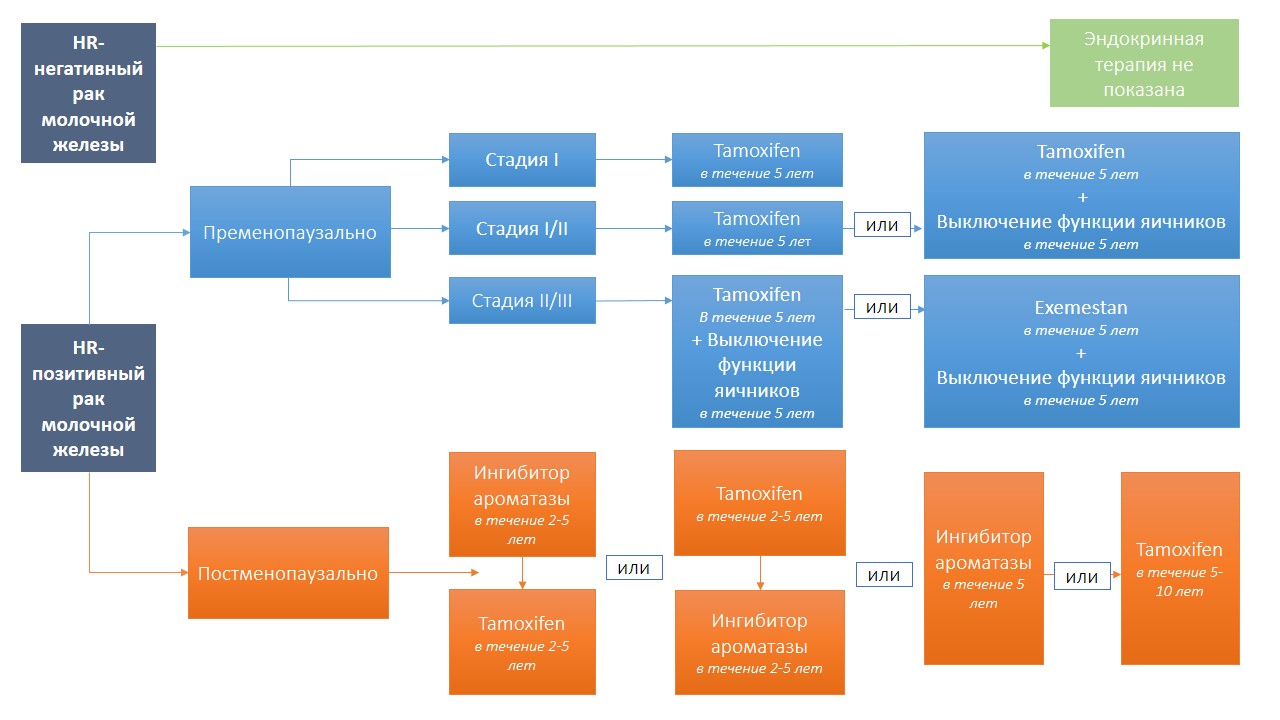
Источник: собственное представление на основе анализа публикаций
При показаниях к адъювантной химиотерапии, эндокринная терапия начинается лишь по окончанию терапии цитостатиками.
Пременопаузально (адъювантная эндокринная терапия)
Менопаузальный статус женщины определяется по анамнезу менструаций, анамнезу гинекологических хирургических вмешательств (например, гистерэктомии, аднексэктомия), а также по анализу крови на фолликулостимулирующий гормон (ФСГ) и эстрадиол (Е2). Основой эндокринной терапии является тамоксифен (Tamoxifen) в течении ≥ 5 лет (см. схему выше). Вопрос о выключении яичников является достаточно спорным, но считается, что чем выше вероятность рецидива и чем моложе пациентка, тем действенней кажется выключение яичников, которое проводится тремя способами:
- аналоги гонадотропин-рилизинг гормона;
- овариэктомия;
- радиоменолиз.
Последние клинические исследования показали, что ингибиторы ароматазы при условии выключения яичников у пациенток с раком молочной железы позволяет уменьшить риск рецидива.
Постменопаузально (адъювантная эндокринная терапия)
В качестве адъювантной эндокринной системной терапии у постменопаузальных пациенток применяется тамоксифен (Tamoxifen) и ингибиторы ароматазы. Прием тамоксифена в течении ≥ 5 лет в метаанализе Early Breast Cancer Trialists‘ Collaborative Group у ER-положительных пациенток показал снижение смертности на 30%, непосредственно связанную с опухолью, в сравнении с пациентками, не получавшими адъювантную эндокринную системную терапию.
Ингибиторы ароматазы в качестве терапии первой линии (upfront) в первые два года после начала терапии приводят к значительному снижению риска рецидива и тем самым смертности. Особенно терапия ингибиторами ароматазы показана пациенткам, относящимся к повышенной группе риска, например, со статусом N+, либо в качестве моно- или последовательной терапии с переходом на тамоксифен.
Длительность адъювантной эндокринной терапии
Стандартным периодом адъювантной гормональной терапии с ориентировкой на тамоксифен считается 5 лет. Продление данного периода путем перехода на ингибиторы ароматазы уменьшает риск рецидива. Хотя последние клинические исследования показали, что расширенная адъювантная терапия Tamoxifen до 10 лет значительно снижает риск рецидива. Однако продление гормональной терапии до 10 лет зависит от соотношения пользы и риска в случае каждой пациентки индивидуально, особенно у пациенток в пременопаузальный период с повышенным риском рецидива, например, при статусе N+, размере опухоли >2 см и гистологически подтверждённой степени G3. Пациенткам же в постменопаузальный период после 5 лет терапии тамоксифеном в качестве расширенной эндокринной терапии может быть предложена терапия ингибиторами ароматазы.
HER2-позитивный рак молочной железы (адъювантная анти-HER2 терапия)
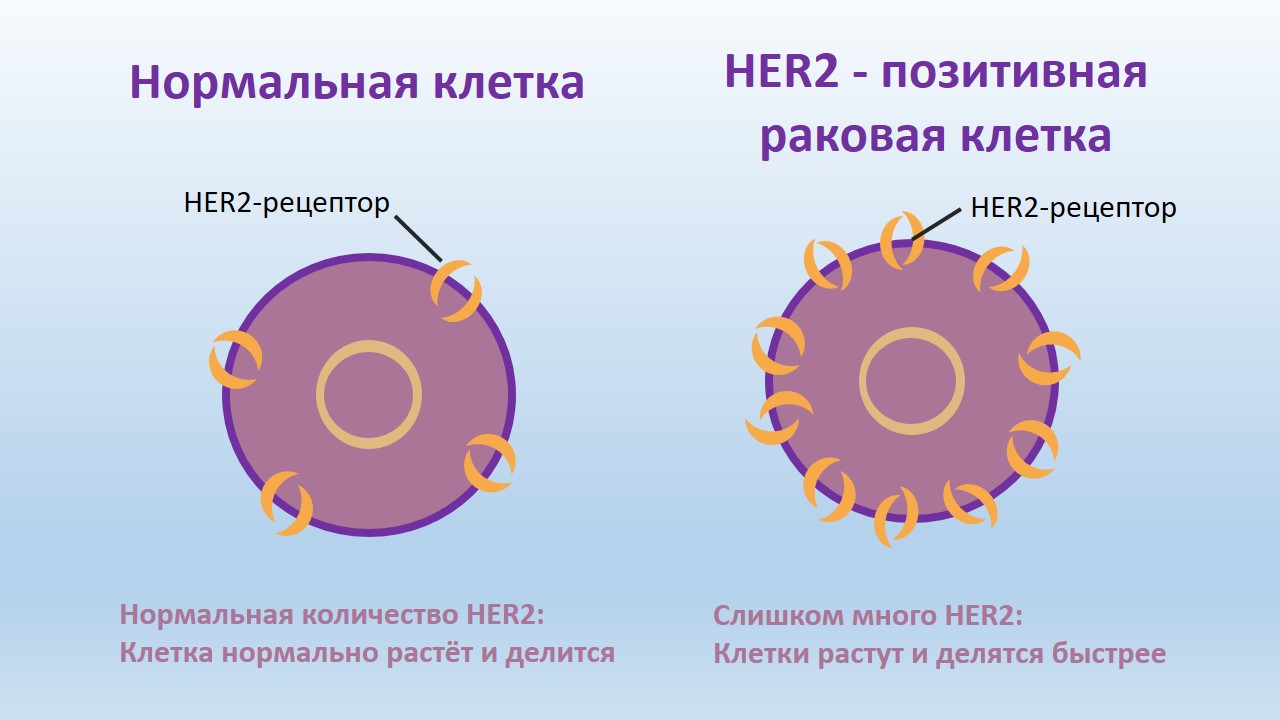
Источник: собственность компании
- иммунногистохимеского исследования: Score 3+;
- гибридизации in-situ (2-мя ДНК-зондами: HER2/ центромер 17 — показатель >2;1-им ДНК-зондом: >6 сигналов HER2 / нуклеус).
В случае пограничных результатов (2+ IHC, ≥ 4 — <6 сигналов HER2 ISH), необходимо провести новое определение с использованием другого метода или на другом опухолевом блоке.
Препаратом для адъювантной терапии является моноклональное антитело трастуцумаб (Trastuzumab), которое снижает риск рецидива в сравнении с проведением исключительно химиотерапии. Пациенткам с положительным HER2-статусом показана адъювантная терапия трастуцумабом в течение одного года, хотя исключением могут являться пациентки с карциномой молочной железы с N0-статусом и размером опухоли <5 мм. Крупные рандомизированные исследования эффективности трастуцумаба проводились исключительно с химиотерапией, комбинированной или последовательной. Как правило, трастуцумаб назначается одновременно с таксанами и последовательно после антрациклинов. Более того, существует также дуальная блокада рецептора HER2: пертуцумаб (Pertuzumab) + трастуцумаб (Trastuzumab).
Трижды негативный рак молочной железы
Трижды негативной обозначается карцинома молочной железы с отсутствием экспрессии на рецептор эстрогена (ER <1%), на рецептор прогестерона (PR <1%), а также на HER-2 (≤2, а также негативный статус FISH). Трижды негативный рак молочной железы является биологически гетерогенным (см. таблицу ниже):
|
Подтипы трижды негативного рака молочной железы |
||
|
Гистология |
Прогнозы |
|
|
инвазивный протоковый |
неблагоприятный |
|
|
нейроэндокринный |
неблагоприятный |
|
|
апокринный |
G3 |
неблагоприятный |
|
G2 |
умеренный |
|
|
G1 |
благоприятный |
|
|
медуллярный |
благоприятный |
|
|
аденоидно-кистозный |
благоприятный |
|
G — гистологическая степень злокачественности (Grade).
Антрациклины и таксаны являются действенными препаратами при трижды негативной карциноме молочной железы, являясь основой первичной или адъювантной химиотерапии. Также платиносодержащие препараты используются в качестве первичной химиотерапии, т. е. в качестве неоадъювантной терапии.
Адъювантная химиотерапия
В таблице ниже представлены факторы риска, разделенные на три категории, в зависимости от их значимости для проведения адъювантной химиотерапии. Обобщенная оценка всех факторов является основой для рекомендаций по лечению Германии.
|
|
против химиотерапии |
неясная значимость |
за химиотерапию |
Прогностические (prognostic) |
|||
первичная опухоль |
≤2 см |
|
|
статус лимф. узлов |
N0 |
1-2 пораженных л/у |
≥4 пораженных л/у |
гистологическая степень злокачественности (Grade) |
G1 |
G2 |
G3 |
инфильтрация сосудов |
отсутствует |
|
обширная |
Прогностические (prognostic) и предсказывающие (predictive) |
|||
HR-статус1 |
≥50% положителен |
<50% положителен |
отрицательный |
HER2-статус |
отрицательный |
отрицательный |
положительный |
молекулярный подтип2 |
люминальный А |
|
люминальный В |
|
|
|
|
выраженный HER2 (HER2 enriched) |
|
|
|
|
базальный (basal-like) |
Прочие |
|||
генные мутации3 |
низкий риск рецидива |
средний риск рецидива |
высокий риск рецидива |
пролиферация (Ki67)4 |
низкая |
|
высокая |
uPA / PAI5 |
низкий |
|
высокий |
1ER — рецептор эстрогена; 2см. статью «Рак молочной железы: классификация», 3тест на экспрессию генов — оценка транскрипции значимых для прогноза генов; 4см. «Рак молочной железы: классификация»; 5uPA/PAI-1 — урокиназный активатор плазминогена и ингибитор активатора плазминогена, тип 1
Протоколы терапии
Адъювантная химиотерапия снижает риск рецидива, необходимость которой определяется индивидуально в зависимости от биологических характеристик опухоли и стадии заболевания (см. таблицу выше). Как правило, при карциноме молочной железы адъювантная химиотерапия состоит из двух, а чаще из трех цитостатических препаратов, которые вводятся либо одновременно, либо последовательно. Ниже представлены основные комбинации и виды химиопрепаратов, используемых в качестве адъювантной терапии рака молочной железы.
Химиотерапия
Антрациклины:
- антрациклин-содержащие схемы являются более эффективными, чем протокол CMF (Cyclophosphamid, Methotrexat и 5-Fluorouracil). Исключение составляют эквивалентные 4 цикла химиотерапии по протоколу АС (например, такие антрациклины, как Doxorubicin или Epirubicin + Cyclophosphamid) или 6 циклов химиотерапии по протоколу CMF каждые три недели у пациенток с гормононезависимым раком молочной железы;
- Рассчитанная дозировка Doxorubicin должна составлять ≥20 мг/м2 в неделю и Epirubicin ≥30 мг/м2 в неделю. Антрациклины вводятся либо каждые две, либо каждые три недели (для сравнения представлена недельная дозировка);
- При наличии противопоказаний к терапии антрациклинами, терапия по протоколу CMF эффективнее, чем не проведение вообще никакой химиотерапии. Так, у пациенток старше 65 лет CMF является более действенной, чем монотерапия Capecitabin;
- Альтернативой для пациенток с низким риском рецидива, например, со статусом N-, или с противопоказаниями к антрациклинам может являться комбинация Docetaxel/Cyclophosphamid.
Таксаны:
- Комбинация из таксанов и антрациклинов, вводимых либо одновременно, либо последовательно, считается более эффективной у пациенток с высоким риском рецидива, чем исключительно антрациклин-содержащая химиотерапия. Данная эффективность не зависит от возраста, менопаузального статуса, количества пораженных лимфатических узлов, а также от гормонального статуса;
- Последовательное введение 4 циклов Docetaxel после 4 циклов Doxorubicin/Cyclophosphamid является равнозначной с одновременным введением всех трёх препаратов с точки зрения свободных от рецидивов периодов и общей выживаемости. Однако одновременное введение сопряжено с повышенным риском инфекции, поэтому больше не рекомендуется;
- Docetaxel и Paclitaxel в принципе доказали свою эквивалентность. При последовательной терапии после антрациклинов, еженедельное введение Paclitaxel или введение Docetaxel каждые три недели оказались действеннее, чем терапия Paclitaxel каждые три недели. Более того, еженедельные 12 циклов Paclitaxel являются эффективными и хорошо переносимыми.
Адъювантная терапия путем воздействия на обмен веществ в костях
Бисфосфонаты и анти-RANKL антитела снижают риск развития остеопороза, а также потенциально обладают клинически значимыми анти-неопластическими свойствами. По этой причине терапия бисфосфонатами может быть рассмотрена в качестве профилактики костных метастазов, особенно в случае постменопаузальных пациенток. Более того, еще одним показанием к применению бисфосфонатов (в т. ч. Denosumab, моноклональное антитело, имитирующее действие остеопротегерина в метаболическом процессе в костной ткани) является профилактика связанных с остеопорозом костных осложнений во время адъювантной терапии ингибиторами ароматазы.